ハイギョは現生魚類の中で最も陸上脊椎動物(両生類や有羊膜類など)に近い生物である。その名の通り肺を持っている魚である。エラも持っており、エラと肺、両方で呼吸ができる特殊な魚である(他にもポリプテルスなどが同様に肺とエラ両方持っている)。
また、一部のハイギョでは水が干上がった乾季などにおいては泥の中に繭を作って乾眠(夏眠)することが知られている。以前の記事ではこの繭が生きた細胞であることを紹介した(Heimroth et al., 2021)。
実際にハイギョを陸上で飼育を行うと繭を作るが、餌を食べなくなり、動かなくなる。代謝が抑制されているようで、何年も繭の中で過ごすことが可能だとも言われている。

この乾眠中のハイギョを研究することは魚類の陸上適応を明らかにする上で重要な鍵となると考えられてきた。これまでいくつかのトランスクリプトーム(RNA-seq)を用いた研究が行われてきたが、その頃はまだハイギョゲノムが決定されていなかったこともあり、正直確実性、包括性という点において解析し直す価値は十分にある。
今回紹介する論文ではハイギョ(Protopterus annectens)のエラ、肺のシングルセルトランスクリプトーム(single cell RNA-seq, scRNA-seqとも。発現している遺伝子を一細胞レベルでシーケンス解析すること)した。つまり、その器官にどんな細胞種が含まれているか、そうした多様性のようなものを評価することが可能となる。さらに陸上環境で飼育したものと比較することで、発現変動遺伝子についても同定している。
Zhang, R., Liu, Q., Pan, S. et al. A single-cell atlas of West African lungfish respiratory system reveals evolutionary adaptations to terrestrialization. Nat Commun 14, 5630 (2023). https://doi.org/10.1038/s41467-023-41309-3
以下、論文の図をCC-BY 4.0に従って引用する。
実験概要
今回の実験にはアネクテンス(西アフリカハイギョ)が用いられている。
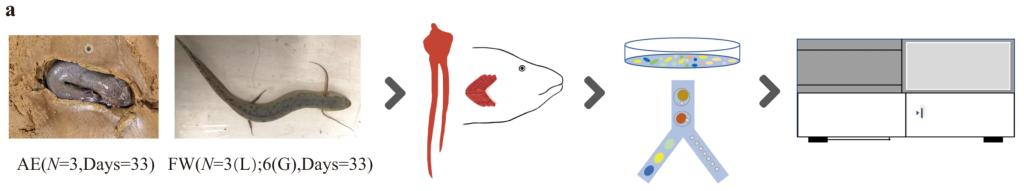
これを片方の群を33日陸上で飼育し乾眠させ、コントロール群はそのまま水中で飼育した。それらのハイギョについて、エラ(内鰓)と肺を切り出した。
「陸上飼育をやってみたい!」という研究者のためにコメントを添えておくと、ハイギョの陸上飼育は意外と難しく、「泥を深く用意する」「純粋な泥だと手足が擦れて無くなるので再生研究に用いる場合は腐葉土などの柔らかい素材を推奨」「水を絶対に切らさない」などのコツがある。余談だが、泥を出入りしている業者に発注したら「土嚢を納品したのは初めてです……後学のために何の目的かお訊きしていいですか?」と言われたりもした。
解剖した組織は酵素によって細胞をバラバラにし、フィルターを通している。細胞濃度を調整し、scRNA-seq用のライブラリ調整キットを使い、ライブラリを作製した。シーケンスはDNBSEQを使っている。一部のエラサンプルにはMGISEQを使っているようだ。
ハイギョの肺とエラの細胞種アトラス
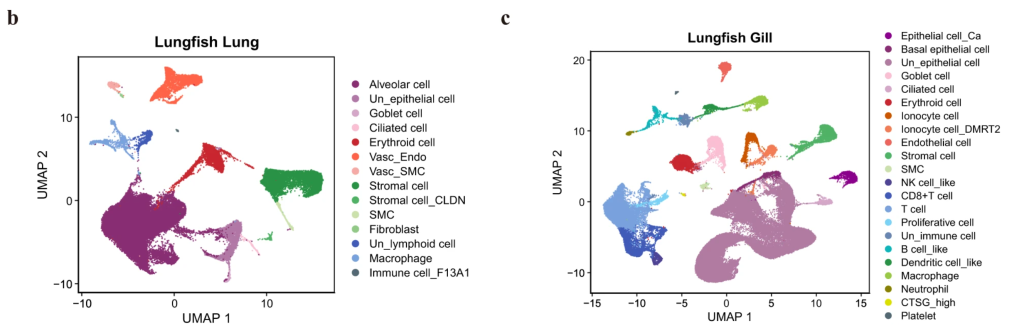
21個(肺)、27個(エラ)のscRNA-seqライブラリから、それぞれ53,605個、87,347個の細胞を取得した。Seurat(Hao et al., 2021; フランス画家ジョルジュ・スーラの点描画とかけている)を使用し、マーカー遺伝子の特定、細胞クラスタの予測を行い、UMAP(教師なし次元削減法)を使用し二次元上に図示した。
肺では(b)上皮細胞などに加え、肺胞細胞の存在が示唆された。電顕の先行研究と細胞種は一致しているようだ。実際にヒトの肺胞上皮細胞(b中の紫)で高度に発現している遺伝子、slc34a2についてscRNA-seqのデータから肺胞上皮細胞を同定した。哺乳類の肺胞上皮細胞はさらにいくつかのサブタイプにまで分けることができるようだが、ハイギョではそのような階層性は見られなかった。アフリカツメガエルの肺でも同じく階層性は見られないらしい。まだ両生類までの段階では肺胞が高度に発達していないということかな。
エラについて(c)、免疫細胞の割合が肺よりも高いことが示された。おそらく外界(水)と直接接しているからだと推測している。また、浸透圧調節に関わる塩類細胞についても同定している。
それぞれマーカー遺伝子について染色を行い、局在の確認等を行っている(本文参照)。
陸上化ハイギョは代謝が抑制されている?
ハイギョにおける乾眠は乾季という一時的な季節に対する反応である。陸上環境では水がないためにエラ呼吸が機能しない。基本的に肺呼吸・皮膚呼吸に依存するようになる。また、陸上化に伴う肺とエラの変化というものは可塑性(元に戻る)である。
陸上飼育したハイギョのエラ・肺についてscRNA-seqの結果を元に細胞種の比較を行ったが、ほとんど違いは検出されなかった。
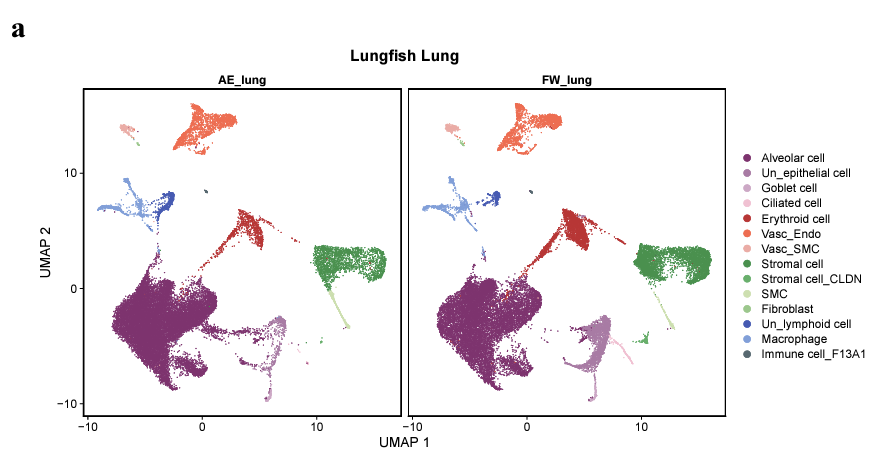
しかし細胞種が同じであったとしても、その細胞で発現している遺伝子自体や発現量が変化している可能性がある。そこで著者らは発現変動遺伝子(DEG)解析を行った。乾眠中のハイギョは代謝の抑制と共に呼吸も抑制されている。そのため、おそらくそれに相関した赤血球のヘムの合成に関わる酵素、alas1, alas2 の発現の低下が見られた。細胞種の割合は同じというが、赤血球自体が減っている可能性はないのだろうかと思ったが、特に触れられてはいない。肺とエラ両方で観察されたので、赤血球一般に通じるものだと思われる。
また、肺では328個の遺伝子がアップレギュレート(発現量増加)、639個の遺伝子がダウンレギュレートされていることが明らかになった。細胞のエネルギー産生に関わる電子伝達系の遺伝子がダウンレギュレートされていることから、代謝の低下を反映していると考えられる。
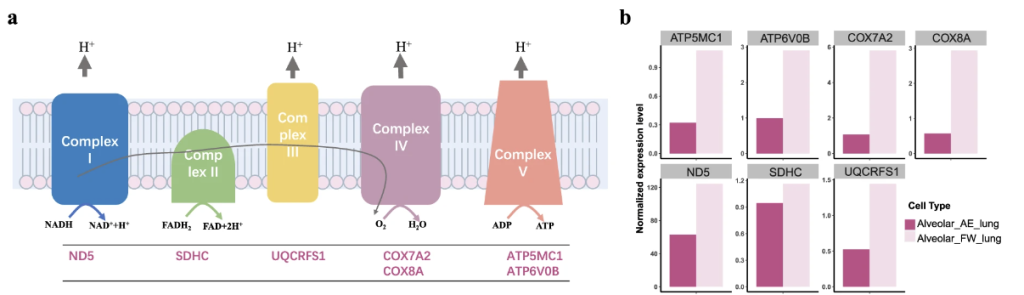
陸上環境でアップレギュレートされた遺伝子には npc2, mgst1, dnajb13, ccdc39, dnaaf1 などが含まれているが、抗酸化であったり、肺の拡大化が起きていることを示唆している。
淡水中と陸上でのエラの違い
ハイギョは淡水中では酸素の約90%の肺から得ているが、残りの10%はエラから摂取していると言われている(Burggren and Johansen, 1986(注: 本文引用文献の引用ミス))。ハイギョは陸上化するときにエラから粘液を分泌し、最終的にはエラは粘液で覆われ機能しなくなると言われている。
酸素摂取の10%しかエラに依存していないにも関わらず、二酸化炭素の排泄の大部分はエラに依存している(Clack et al., 2010)。これは二酸化炭素が水に溶けやすいという特徴に起因していると考えられている。同じく肺呼吸をするポリプテルスでは高二酸化炭素水中ではエラ呼吸が抑制されることが知られている(Babiker, 1984; Kimura et al., 2023)。なんにせよ、陸上では水がないために肺から二酸化炭素を放出していると考えられてきている。
また、エラは浸透圧調節、酸塩基調節にも重要な役割を果たしている。塩類細胞について、陸上環境でダウンレギュレートされた遺伝子を調べたところ、イオン輸送に関わる遺伝子群がエンリッチされていた。
著者らはエラについて、細胞間の相互関係についても調べている。これにはCellPhoneDBというリガンド・受容体の複合発現から解析するという手法を用いている(Efremova et al., 2020)。
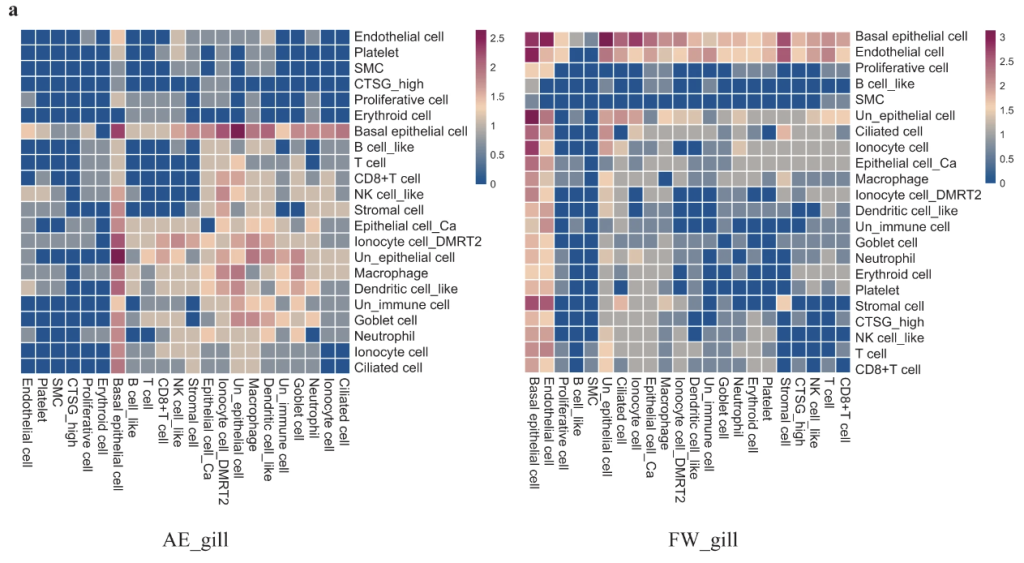
22種類のエラ細胞において、51のリガンド-受容体(LR)ペアが検出され、それは水中の方(上図右)がスコアが高いことがわかった。GO解析により、陸上化したハイギョのエラでは血管構造の形態形成がエンリッチされていることが明らかになった。nrp1:vegfa のLRペアが陸上でより発現量が高かった。これらはハイギョのエラ血管系が陸上で縮退せずに拡張しているという観察を裏付けるものとなる。
肺とエラの Cell type の進化
ハイギョのscRNA-seqのデータが得られたため、ヒト肺、マウス肺、ゼブラフィッシュ浮袋(注: 浮袋は肺と相同な器官)、タイセイヨウサケ(Atlantic salmon)浮袋、ゼブラフィッシュエラと比較解析を行った。
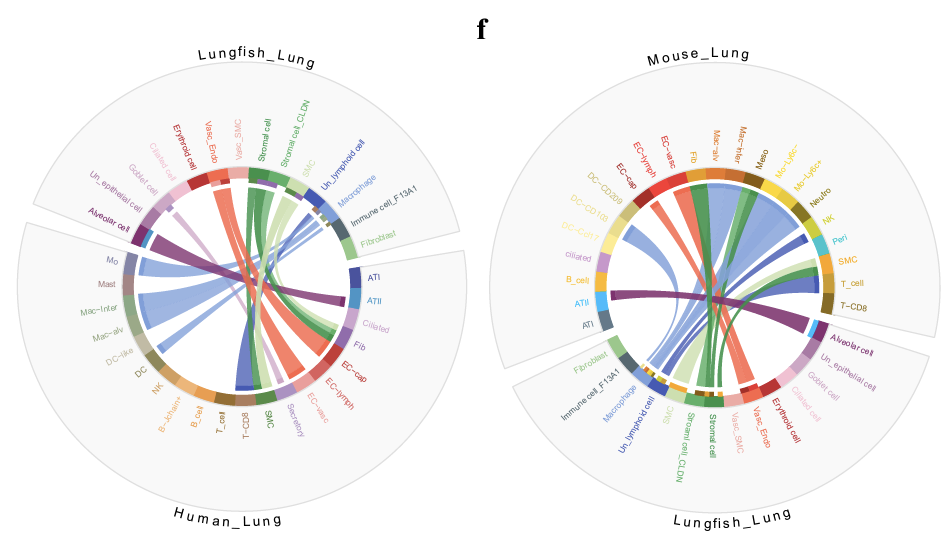
ハイギョと哺乳類の肺の比較では、肺胞上皮細胞、繊毛細胞、リンパ系細胞が哺乳類のATII細胞、繊毛細胞、T細胞と類似していることが示された(図を見ると線が引かれていない気がするが、下図では線で結ばれている)。ただ、多くの免疫細胞タイプは哺乳類とは異なるようだ。
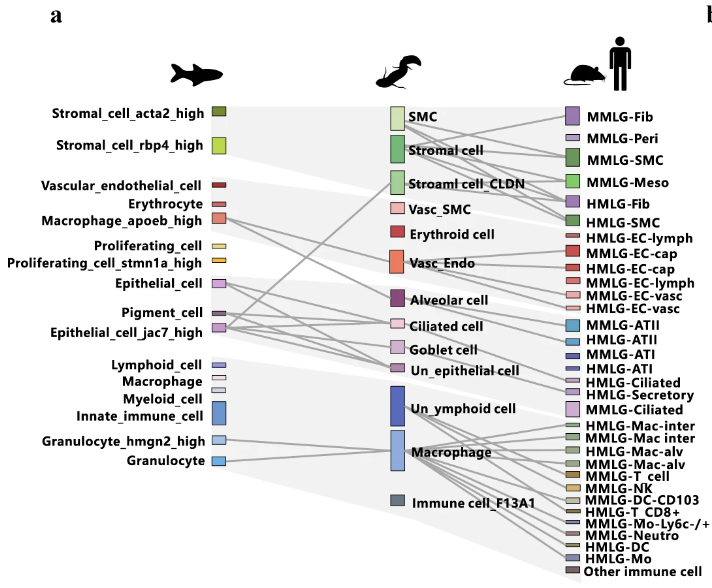
ゼブラフィッシュ浮袋も含めて細胞タイプの類似性を見ると、ゼブラフィッシュの浮袋とハイギョの肺は自然免疫機構といった点で類似しており、哺乳類の肺細胞とは空気呼吸・適応免疫(Adaptive immunity)といった点で類似している。なんとなく、中間段階のところに位置しているように見えるが、進化的には「原始肺(硬骨魚類の祖先で獲得)」→①「発達した肺(陸上動物の系統)」
→②「原始的な肺(ポリプテルスなどで維持)」→「浮袋(真骨魚類など)」
という順を辿っている。浮袋から肺が生じたわけではないので注意。
まとめ
本研究ではこれまで形態的、あるいはバルクRNA-seqによってのみ特徴づけられていたものが、一細胞レベルで明らかになったという点で大きな意義がある。
scRNA-seqの結果、細胞種としては大きく変わってはいないものの、代謝が抑えられたり、エラのガス交換や塩類摂取に関わる機能が落ちている可能性が示唆された。
また、ゼブラフィッシュの浮袋とは起源が同じといえども分岐してから相当な時間が経過している。それにもかかわらず部分的な相同性が見られたことは注目に値するのではないかと思われる。また、ハイギョの内鰓は条鰭類(シーラカンス・ハイギョ・サメなどを除いたほとんどの魚類)と比べてだいぶ縮退した構造を持っているが、イオン調節やガス交換などの機能は維持しているようだ。
これからこのscRNA-seqのデータを再解析していくことで、魚の陸上適応についてより深い理解を得られるようになるだろう。
参考文献
- Zhang, R., Liu, Q., Pan, S. et al. A single-cell atlas of West African lungfish respiratory system reveals evolutionary adaptations to terrestrialization. Nat Commun 14, 5630 (2023).
- Heimroth, Ryan Darby, Elisa Casadei, Ottavia Benedicenti, Chris Tsuyoshi Amemiya, Pilar Muñoz, and Irene Salinas. “The lungfish cocoon is a living tissue with antimicrobial functions.” Science advances 7, no. 47 (2021): eabj0829.
- Hao, Yuhan, Stephanie Hao, Erica Andersen-Nissen, William M. Mauck, Shiwei Zheng, Andrew Butler, Maddie J. Lee et al. “Integrated analysis of multimodal single-cell data.” Cell 184, no. 13 (2021): 3573-3587.
- Burggren, Warren W., and Kjell Johansen. “Circulation and respiration in lungfishes (Dipnoi).” Journal of Morphology 190, no. S1 (1986): 217-236.
- Clack, Jennifer A., Esther L. Sharp, John A. Long, J. M. Jørgensen, and J. Joss. “The fossil record of lungfishes.” The biology of lungfishes (2011): 1-42.
- Babiker, M. M. “Development of dependence on aerial respiration in Polypterus senegalus (Cuvier).” Hydrobiologia 110 (1984): 351-363.
- Kimura, Yuki, Nobuaki Nakamuta, and Masato Nikaido. “Plastic loss of motile cilia in the gills of Polypterus in response to high CO2 or terrestrial environments.” Ecology and Evolution 13, no. 4 (2023): e9964.
- Efremova, Mirjana, Miquel Vento-Tormo, Sarah A. Teichmann, and Roser Vento-Tormo. “CellPhoneDB: inferring cell–cell communication from combined expression of multi-subunit ligand–receptor complexes.” Nature protocols 15, no. 4 (2020): 1484-1506.







![【Qiskit】マルチオミクス解析を量子機械学習でやる①[環境構築・基礎]](https://kimbio.info/wp-content/uploads/2024/05/2203027-100x100.jpg)