我が地球上の生命の進化の原動力はDNAの点突然変異によるものである。ではその突然変異はどのようにして引き起こされるのだろうか? 高校や学部生の教科書的には「DNA複製時に極めて低い確率で起こる」と書かれているが、直接的な要因について触れているものはない。
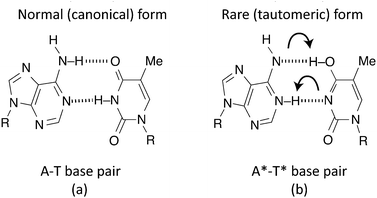
DNAの二重らせん構造を発見・提唱したワトソンとクリックはDNA塩基対のエネルギー的に不利な互変異性体について言及している(Watson and Crick, 1953)。このDNAの文脈における互変異性体について軽く触れておくと、核酸塩基は通常安定なケト型やアミノ形を取っているが、これから説明するような事由によってエノール型、イミノ型へと互変異性化することが知られている。この互変異性化によってA-T、G-C対ではないA-C対やG-T対などが作られてしまう。それが複製の際に点突然変異となる。
今回はB型DNA(通常の二重らせん構造、Watson-Crick conformation)の点突然変異について、量子力学の観点からの研究を少しだけ紹介したい。
トンネル効果による互変異性化
この互変異性化が何によって生じるかということだが、現在考えられている候補のひとつに「水素原子の量子力学的なトンネリング」がある(Löwdin, 1963)。メカニズムとしては、DNAの二本鎖の上のヌクレオチド塩基対を隔てる「障壁」をプロトンが量子トンネル効果によって通過することで生じる、というものである。
量子力学におけるトンネル効果について軽く触れておく。ある物質が障壁に向かって向かっているとする。極めて微細なスケールにおいて、この物質がこの障壁を乗り越えられるだけのエネルギーを有していないような場合においても、ある確率において物質が障壁を通過することができる、というものだ。
CC-BY 3.0
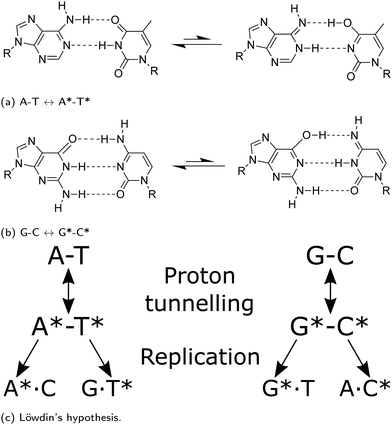
上の図のように、二本鎖の間の障壁を「トンネル効果」をもってして「すり抜け」ることで標準的な塩基から互変異性型の塩基へと変化する。この互変異性体の塩基対が、ヘリカーゼ(DNAの二本鎖の分離を行う酵素)による切断プロセスを経てもなお存在し続けた場合、それぞれの鎖は複製の際に本来とは異なる塩基対を形成しうる、と考えられている(Solocombe et al., 2022など)。
CC-BY 3.0
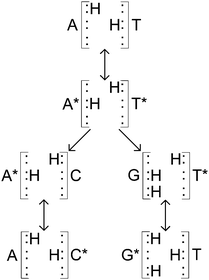
上の図に表されているように、互変異性体となったA*は本来の対の塩基であるTではなく、Cと塩基対を形成したほうがエネルギー的にはるかに有利であることがわかっている。同様にT*もAではなくほぼ確実にGと結合する。この「エラー」が変異を修正するプロセスを経ても生き延びた場合、突然変異が生じたということになる (Godbeer et al., 2015)。
このプロトンの移動による変異というものは半世紀以上にわたって議論が続いており、反論としては「(不安定な)互変異性体がDNAの複製プロセスを生き延びることができない(ナノ秒レベルのタイムスケールにわたって存在しなければならない)」というものが挙げられている (Brovarets and Hovorun, 2019など)。
CC-BY 3.0
また、上の図のように、この陽子の移動というものは「二回」生じている。この二回の陽子の移動は観察などによって非同期的に起きていると言われている(Godbeer et al., 2015)。ひとつの陽子が他方にトンネル効果によって移動し、もう一つの陽子が電気的中性を保つために反対方向に移動するのではないかと考えられている。
最近の理論上、およびコンピュータ上の研究では、正規のGCと互変異性体G*C*の間の大きな活性化エネルギーによって長寿命であり、ヘリカーゼおよび続く塩基対の形成までの間にG*C*からGCに戻る可能性は低いと予想されている (Solocombe et al., 2021など)。
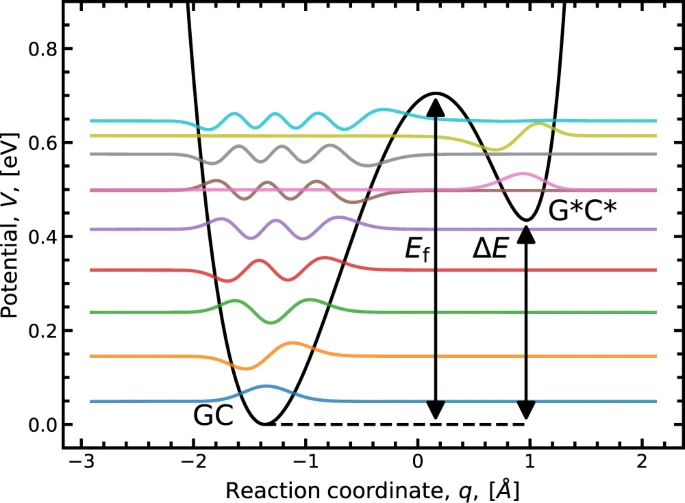
ただしこれはまだ実験的に確かめられているわけではないので、今後実験などによって塩基の互変異性化のメカニズムが明らかにされることが期待される。
参考文献
- Watson, J. D., & Crick, F. H. (1953, January). The structure of DNA. In Cold Spring Harbor symposia on quantitative biology (Vol. 18, pp. 123-131). Cold Spring Harbor Laboratory Press.
- Löwdin, P. O. (1963). Proton tunneling in DNA and its biological implications. Reviews of Modern Physics, 35(3), 724.
- Slocombe, L., Al-Khalili, J. S., & Sacchi, M. (2021). Quantum and classical effects in DNA point mutations: Watson–Crick tautomerism in AT and GC base pairs. Physical Chemistry Chemical Physics, 23(7), 4141-4150.
- Slocombe, L., Sacchi, M., & Al-Khalili, J. (2022). An open quantum systems approach to proton tunnelling in DNA. Communications Physics, 5(1), 109.
- Brovarets’, O. H. O., & Hovorun, D. M. (2019). Atomistic mechanisms of the double proton transfer in the H-bonded nucleobase pairs: QM/QTAIM computational lessons. Journal of Biomolecular Structure and Dynamics, 37(7), 1880-1907.
- Godbeer, A. D., Al-Khalili, J. S., & Stevenson, P. D. (2015). Modelling proton tunnelling in the adenine–thymine base pair. Physical Chemistry Chemical Physics, 17(19), 13034-13044.



![【Qiskit】マルチオミクス解析を量子機械学習でやる①[環境構築・基礎]](https://kimbio.info/wp-content/uploads/2024/05/2203027-100x100.jpg)